
Kalsiyum Atom Numarası Nedir?
Kalsiyum, doğada yaygın olarak bulunan, önemli fiziksel ve kimyasal özelliklere sahip bir elementtir. İnsan vücudunda kemik sağlığı ve çeşitli biyolojik işlevler için elzemdir. Ayrıca endüstride çeşitli alanlarda geniş bir kullanım yelpazesi sunar. Yeterli alımı sağlık açısından kritik öneme sahiptir.
Kalsiyum, periyodik tablodaki 20. elementtir ve atom numarası 20 olarak tanımlanır. Atom numarası, bir elementin çekirdeğindeki proton sayısını ifade eder ve bu nedenle bir elementin kimyasal özelliklerini belirleyen en önemli özelliklerden biridir. Kalsiyum, alkali toprak metaller grubuna ait bir elementtir ve genellikle Ca sembolü ile gösterilir. Kalsiyumun Fiziksel ve Kimyasal Özellikleri Kalsiyum, gümüş-beyaz bir metal olup, doğada yaygın olarak bulunan bir elementtir. İşte kalsiyumun bazı fiziksel ve kimyasal özellikleri:
Kalsiyum, yüksek reaktiviteye sahip bir elementtir ve özellikle su ve asitlerle kolayca reaksiyona girer. Bu özellikleri nedeniyle, kalsiyum genellikle doğada serbest halde bulunmaz, ancak kalsiyum karbonat (CaCO₃) ve kalsiyum sülfat (CaSO₄) gibi bileşikler şeklinde bulunur. Kalsiyumun Biyolojik Önemi Kalsiyum, insan vücudu için hayati öneme sahip bir mineraldir. Vücutta, kemiklerin ve dişlerin yapısında önemli bir rol oynar. Bunun yanı sıra, birçok biyolojik süreçte de kritik bir işlevselliğe sahiptir:
Günlük kalsiyum ihtiyacı yaşa, cinsiyete ve bireyin sağlık durumuna bağlı olarak değişebilir. Yeterli kalsiyum alımının sağlanması, osteoporoz gibi kemik hastalıklarının önlenmesine yardımcı olur. Kalsiyumun Kullanım Alanları Kalsiyum, hem endüstriyel hem de tıbbi alanlarda çeşitli kullanımlara sahiptir:
Bu kullanım alanları, kalsiyumun çok yönlü bir element olduğunu ve çeşitli endüstriyel süreçlerde önemli bir yer tuttuğunu göstermektedir. Sonuç Kalsiyum, atom numarası 20 olan ve birçok fiziksel, kimyasal ve biyolojik işlevselliğe sahip bir elementtir. Vücudumuzda önemli roller üstlenirken, endüstriyel uygulamalarda da geniş bir kullanım yelpazesi sunmaktadır. Kalsiyumun yeterli düzeyde alınması, sağlığımız açısından kritik bir öneme sahiptir ve bu nedenle, kalsiyum kaynaklarının dengeli bir şekilde tüketilmesi önerilmektedir. |















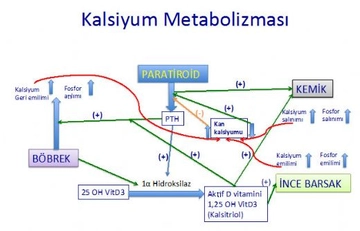





















Kalsiyumun atom numarasının 20 olduğunu ve bu nedenle elektron diziliminin 2, 8, 8, 2 şeklinde olduğunu bilmiyordum. Bu durum, kalsiyumun son katmanında iki elektron bulundurmasını ve dolayısıyla 2A grubunda yer almasını sağlıyor. Bu bilgi, kalsiyumun metalik özelliklerini açıklıyor mu?
Ayşin Hanım, evet, bu bilgi kalsiyumun metalik özelliklerini açıklamaya yardımcı olur. Kalsiyum, son katmanında iki elektron bulundurması sebebiyle, bu elektronları kolayca kaybederek kararlı bir yapıya ulaşır. Bu da kalsiyumun iyi bir iletken olmasını ve diğer metalik özelliklerini göstermesini sağlar. Dolayısıyla, elektron dizilimi ve 2A grubunda yer alıyor olması, kalsiyumun kimyasal ve fiziksel özelliklerini anlamamıza yardımcı olur.